1,042
社区成员
 发帖
发帖 与我相关
与我相关 我的任务
我的任务 分享
分享这是我参加“朝闻道”知识分享大赛第三十四篇文章
有机化学实验
实验名称: 苯甲酸乙酯的制备
一、 实验目的
1.掌握酯化反应原理及苯甲酸乙酯的制备方法
2.巩固分水器的使用、萃取、干燥、蒸馏等操作
二、实验原理
苯甲酸乙酯可由苯甲酸与乙醇在硫酸的催化下合成。直接酸催化酯化反应是经典的制备酯的方法,但该反应是可逆反应,反应物间建立一个动态平衡。为了提高酯的转化率, 一般使用过量乙醇或将反应生成的水从反应体系中除去,使平衡向生成酯的方向移动, 从而提高转化率。该反应采用原料乙醇过量,利用乙醇,环已烷,水三元共沸原理,在反应过程中通过分水器将反应生成的水不断蒸出,使平衡正向移动,提高苯甲酸转化率。
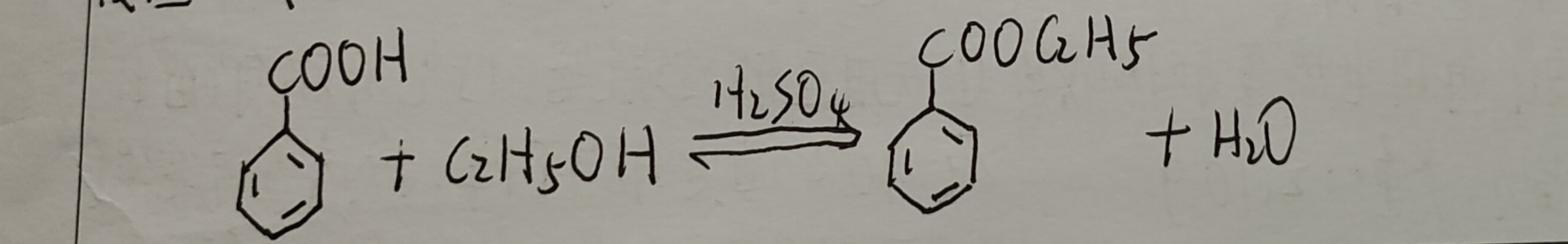 三、主要试剂及用量
三、主要试剂及用量
4.09g(0.0335mol)苯甲酸;10.0mL (0.17mol)无水乙醇(99.5%);1.5ml浓硫酸;10ml环已烷;10mL乙酸乙酯;无水氯化钙;碳酸钠
四、实验步骤及现象
实验步骤
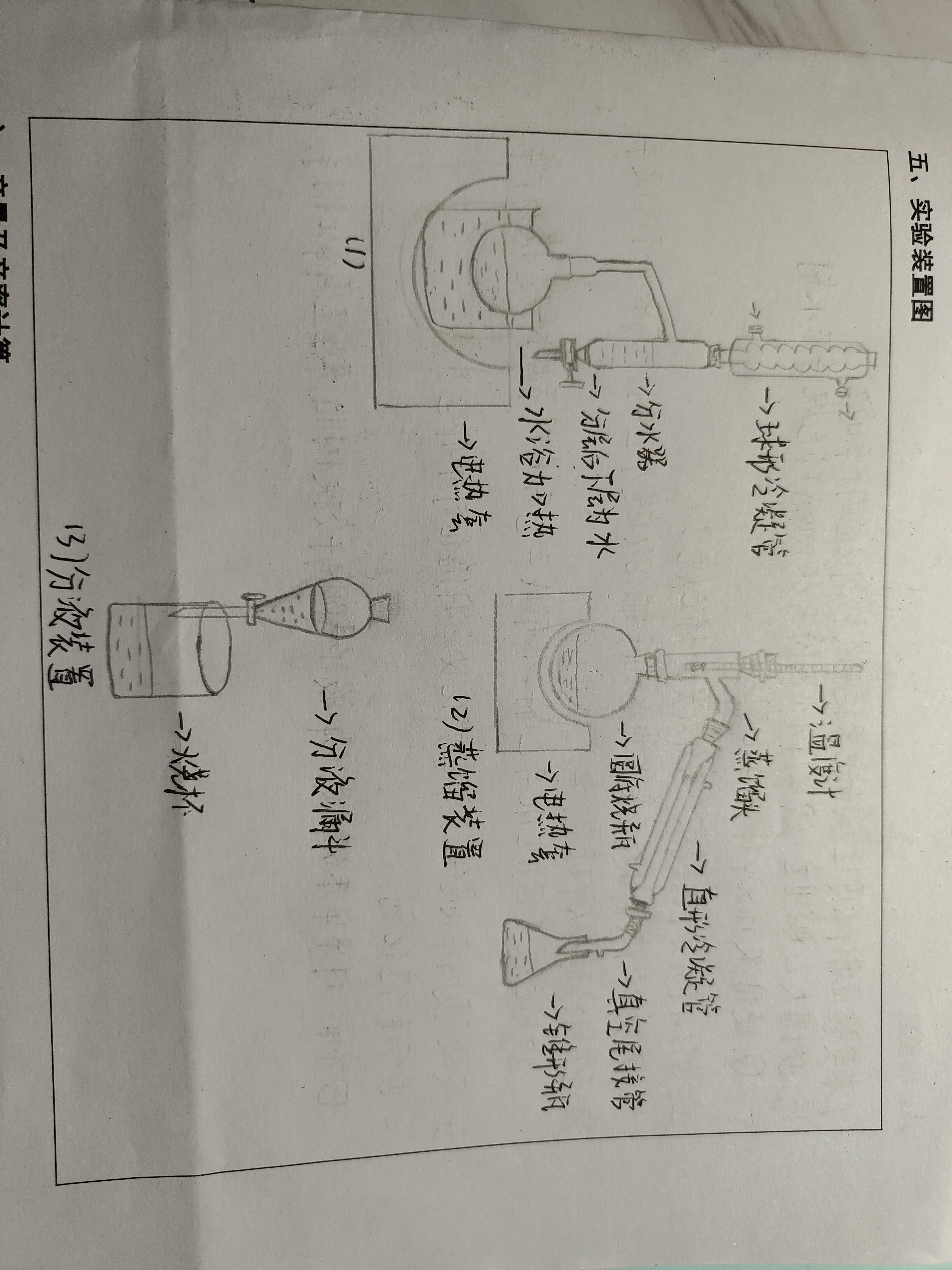
①在50ml圆底烧瓶中加入4.09g苯甲
酸,10ml无水乙醇,10ml环已烷和
1.5ml浓硫酸、摇匀,加沸石
②再装上分水器,从分水器上端小心加水
至分水器支管处再放去3ml,分水器上端
接球形冷凝管
③将烧瓶在水浴上加热回流,随着回
流的进行,分水器中出现了上下两层,
1h20min后,停止加热。
④放出下层液体并记录体积,继续用水
浴加热,使多余的环已烷和乙醇蒸
至分水器中,然后停止加热
⑤将残液倒入盛有30ml冷水的烧杯中,在搅拌下分批加入无水碳酸钠至无二氧化碳气体产生。用PH计纸检验
至呈中性
⑥将混合物入分液漏斗中,分出粗产
物,水层用10ml乙酸乙酯萃取。合并粗
产物和乙酸乙酯萃取液,用无水氧化
钙干燥,当溶液澄清即可
⑦蒸出乙酸乙酯,再用电热套加热收集
210-213℃的馏分,产量:2.10g
实验现象
①加入浓硫酸后,溶液明显放热,摇至混匀,加入1粒沸石。
③加热了1h20min,分水器中出现了
四层
④下层液体:6.1mL
⑤加入无水碳酸钠,粉末消失,产生白色泡沫。无白色泡沫产生后,用PH试纸检
测呈酸性,继续加无水碳酸钠,搅拌至溶解,再用PH试纸检测,至呈中性即可
⑥分液漏斗中有白色状物体,有刺激性气味
用10ml乙酸乙酯萃取后,取上层液体
与粗产物合并,用无水CaCl₂干燥,溶液一
直未澄清,只好静止5min后,取上层清液
⑦先用直形冷凝管,75°开始有馏出
液,90℃温度开始下降,换成空气冷凝
管,用干燥干净,质量已知的锥形瓶接馏分、温度到200℃以上开始有馏分。
锥形瓶:62.61g
馏分+锥形瓶:64.71g
馏分:2.10g
五、实验装置图
六、产量及产率计算
已知苯甲酸n=0.0335mol, 苯甲酸乙酯M=166.19g/mol ,又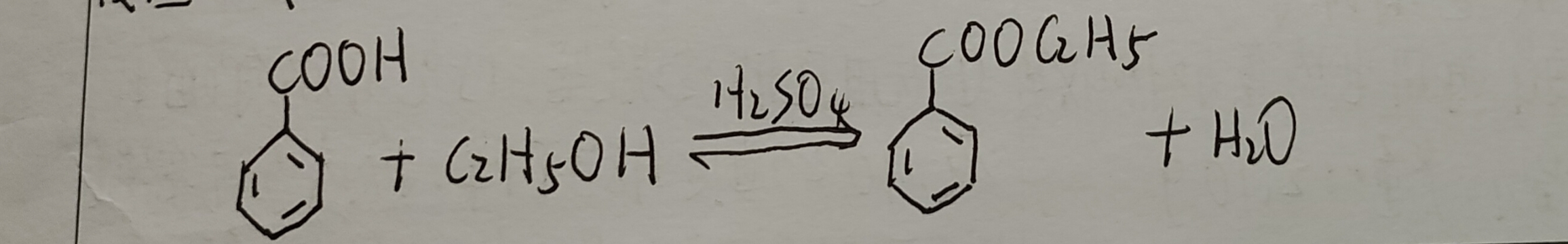
所以理想产量:nM=0.0335x166.19=5.57g
因为锥形瓶:62.61g
锥形瓶+馏分:64.71g
所以实际产量:2.10g
产率=实际产量÷ 理想产量 =2.10÷5.57
=37.7%
七、讨论
我的产率过低。可能原因:使用乙醚萃取后水层中仍有部分絮状物未溶于乙醚,但未进行二次苯取,可能仍有部分粗产物在水层未被提取,导致产率降低。蒸馏装置,气密性不足,所以产率降低
八、思考题
1.本实验应用什么原理和措施来提高该平衡反应的产率的? 答:①增大乙醇用量②使用分水器除去水,加入不已烷等带水剂
③使用浓HSO4作为催化剂
2.为什么采用分水器除水?为什么要加环已烷?答:为了及时分离出反应生成的水。由于酯化反应是可逆的,分离出水可以使平 衡向正反应方向移动,从而提高产率
3.浓硫酸的作用是什么?常用酯化反应的催化剂有哪些?
①作用:催化剂
②常用:对甲苯磺酸,磷酸、阳离子交换树脂,某些金属氧化物等。